Bạn đang quan tâm đến Bioavailability là gì? Vai trò của tương đương sinh học và sinh khả dụng phải không? Nào hãy cùng PHE BINH VAN HOC theo dõi bài viết này ngay sau đây nhé!
Video đầy đủ Bioavailability là gì? Vai trò của tương đương sinh học và sinh khả dụng
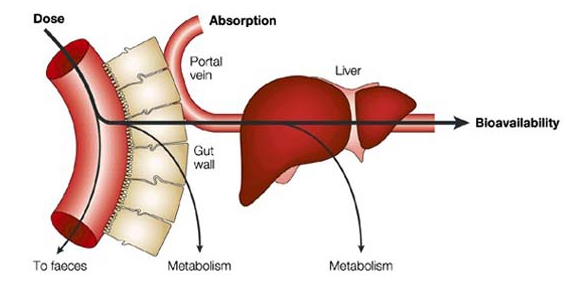
Bioavailability là gì? Bioavailability hay còn gọi là Sinh khả dụng là một địa lượng chỉ tốc độ và mức độ hấp thu dược chất từ một chế phẩm bào chế vào tuần hoàn chung một cách nguyên vẹn và đưa đến nơi tác dụng.
Bioavailability là gì?
Định nghĩa về Sinh khả dụng
Trong Dược lý học, Sinh khả dụng (hay như trong tiếng Anh là bioavailability (BA)) là đại lượng chỉ tốc độ và mức độ hấp thu dược chất từ một chế phẩm bào chế và tuần hoàn chung một cách nguyên vẹn và đưa đến nơi tác dụng, từ đó tiếp tục được chuyển hoá và thải hồi.
Từ định nghĩa, thuốc theo đường tiêm tĩnh mạch có sinh khả dụng là 100%. Tuy vậy, khi thuốc được dùng bằng các cách thức khác nhau (như đường uống) thì sinh khả dụng của thuốc thường giảm (do hấp thu không hoàn toàn và các giai đoạn đầu của quá trình trao đổi chất) hay thay đổi tuỳ thuộc thể trạng bệnh nhân. Sinh khả dụng được xem là một công cụ thiết yếu trong sinh dược học, đây là đại lượng quan trọng để xác định và tính toán liều dùng cho các dạng bào chế không theo đường tĩnh mạch.
Sinh khả dụng tuyệt đối
Sinh khả dụng tuyệt đối được xác định khi so sánh sinh khả dụng của thuốc có hoạt tính lưu hành trong hệ tuần hoàn theo con đường không phải tiêm tĩnh mạch (ví dụ như theo đường uống, đường trực tràng, thẩm thấu qua da, tiêm dưới da hay đặt dưới lưỡi), với sinh khả dụng của cùng dạng thuốc theo đường tiêm tĩnh mạch. Do chỉ có một phần của thuốc hấp thụ theo đường không tiêm tĩnh mạch so với cũng dạng thuốc đó khi tiêm tĩnh mạch, nên sự so sánh này phải được thực hiện trên các liều khác nhau (ví dụ, khảo sát các liều dùng khác nhau hay trên các đối tượng có trọng lượng khác nhau). Từ đó, nồng độ chất hấp thụ sẽ dần được nâng cao bằng cách chia liều lượng dùng hợp lý.
Để xác định được sinh khả dụng tuyệt đối của một loại thuốc ta cần xác định được mối liên hệ giữa thời gian và nồng độ của thuốc lưu hành trong huyết tương. Để biết được mối tương quan trên trước hết phải xác định được liều dùng theo đường tiêm tĩnh mạch (IV) và cả đường không tiêm tĩnh mạch (ví dụ: đường uống). Sinh khả dụng là liều dùng xác định thể hiện bằng diện tích dưới đường cong (AUC) theo đường không tiêm tĩnh mạch chia cho diện tích dưới đường cong AUC theo đường tiêm tĩnh mạch. Ví dụ, công thức tính F (sinh khả dụng) của một loại thuốc được dùng theo đường uống (po) được cho như sau.

Vai trò của tương đương sinh học và sinh khả dụng thuốc trong quản lý chất lượng thuốc trên thị trường
Thực tế hiện nay, với sự phát triển của công nghiệp dược phẩm trên thế giới, đặc biệt tại các quốc gia tiên tiến đã cho ra đời hàng ngày lên đến hàng trăm mẫu mã thuốc mới và hàng chục loại biệt dược thuốc khác nhau. Mỗi năm có hơn 2.6 tỷ đơn thuốc được kêtại Mỹ, có sử dụng các phiên bản generic của các thuốc có sáng chế (brand pharmaceuticals). Điều này tương ứng khoảng 1.2 tỷ dơn thuốc kê dạng brand-name hàng năm ở quốc gia này. Khoảng 70% trong tổng số các đơn thuốc có generic và tất cả bệnh nhân, dược sĩ, thầy thuốc đều nhận ra một giá trị kinh khủng của các laọi thuốc generic phiên bản. Song khó có thể biết được hoặc chưa đánh giá hết liệu các thuốc do nhà sáng chế sản xuất ban đầu với thuốc generic có giá trị như nhau về điều trị hay không (brand-name formualtion và generic formulation), nghĩa là đặc tính sinh khả dụng và tương đương sinh học giữa các thuốc đó có như nhau hay không, đó là chưa kể đến hiệu lực và tính an toàn của thuốc. Cụ thể, là nhiều tin mới diễn ra hàng ngày trên các trang tin trong và ngoài nước đề cập đến loại thuốc A, thuốc B, thuốc C vì không đủ tiêu chuẩn,…trong đó cũng đề cập đến tương đương sinh học. Hoặc một số quốc gia chưa thật sự quan tâm đến vai trờ tương đương sinh học, hay chỉ mới chú trọng đến tương đương sinh học (dạng tương được bào chế) mà chưa quan tâm đến tương đương trị liệu. Một số nghiên cứu trên thế giới cũng cho biết ngoài các chuẩn quy theo lộ trình dánh giá, người ta còn cho biết tác dụng phụ của thuốc dạng brand-name thấp hơn rất nhiều so với thuốc generic (5-7% so với 10-15%).
Do vậy, vai trò tương đương sinh học vừa có ý nghĩa khoa học, vừa là hành lang pháp lý cho nhà chuyên môn và quản lý thực hiện trong sứ mệnh chăm sóc sức khỏe con người, điều đó cũng có nghĩa là đòi hỏi nhà sản xuất, phân phối, quản lý bắt buộc phải hội nhập càng sớm càng tốt à cốt để bệnh nhân an tâm, nhà quản lý không còn phức tạp và việc kê đơn thuốc hợp lý hơn vì đã có thước đo chung là tương đương sinh học. Trên thực tế, trong lĩnh vực dược, nhiều hình thức tương đương như tương đương generic, tương đương lâm sàng, tương đương bào chế, tương đương hóa học, tương đương sinh học, tương đương trị liệu, tương đương dược học,….Trong phạm vi cho phép, tổng hợp một số nội dung liên quan đến tương đương sinh học và sinh khả dụng của thuốc.
Trên thị trường toàn cầu hiện nay, thuốc ngày càng đa dạng và phong phú. Rất nhiều thuốc của nước ngoài đưa vào Việt Nam với giá rẻ từ Ấn Độ, Pakistan, Hàn Quốc, Thái Lan,… thậm chí rẻ hơn thuốc trong nước sản xuất, song song đó còn tồn tại một số loại thuốc nhập từ châu Âu và châu Mỹ hoặc liên doanh với các quốc gia như Ý, Pháp, Canada lại có giá rất đắt. Vấn đề đặt ra là người bệnh sẽ chọn dùng thuốc giá rẻ hay giá đắt và đặc biệt là có thể dùng thuốc an toàn-hiệu quả mà còn “kinh tế” nữa. Điều này có thể lý giải và đưa lời khuyên hợp lý nhất chỉ khi có kết quả hoặc thông tin chứng minh được vấn đề sinh khả dụng và tương đương sinh học của các chế phẩm thuốc.
Một vấn đề nữa đặt ra là khía cạnh sinh khả dụng của thuốc (drug bioavailability) là tốc độ và mức độ đạt được của một thành phần hoạt chất được giải phóng từ một dạng bào chế, được xác định bằng đồ thị “nồng độ – thời gian” của hoạt chất trong hệ tuần hoàn hoặc sự bài tiết hoạt chất trong nước tiểu. Sinh khả dụng của thuốc sẽ khác nhau trong các trường hợp là cùng một dược chất nhưng đường sử dụng khác nhau, cùng đường sử dụng nhưng dạng thuốc khác nhau, cùng dạng thuốc, cùng đường sử dụng nhưng công thức khác nhau. Cơ quan quản lý Dược và Thực phẩm Mỹ (FDA_US Food and Drug Administration) cho biết các vấn đề liên quan hoặc điều kiện chuẩn quy cũng như thông tin cần thiết liên quan đến tương đương sinh học đã có sẵn tại website FDA, hoặc các dạng thiết kế nghiên cứu về tương đương sinh học cũng sẵn có tại phebinhvanhoc.com.vn/.
Thử nghiệm tương đương sinh học (Bioequivalence testing)
Để xác định các đặc tính tương đương sinh học, chẳng hạn giữa 2 thuốc thuốc có sáng chế và thuốc gốc (commercially-available Brand product vs a potential to-be- marketed Generic product),các nghiên cứu dược động học được tiến hành nơi mà các chế phẩm này được chỉ định trong một nghiên cứu trên nhóm đối tượng là những người tình nguyện, nói chung khỏe mạnh nhưng đôi khi trên cả những bệnh nhân. Các mẫu máu huyết thanh hoặc huyết tương lấy theo các khoảng thời gian quy định và được thử nghiemẹ đối với thuốc gốc (parent drug) hoặc nồng độ chất chuyển hóa. Đôi khi, nồng độ thuốc trong máu có thể so sánh đồng thời. Rồi điểm cuối của dược lực học đúng hơn điểm cuối của dược động học để sử dụng so sánh. Để so sánh về dược động học,dữ liệu nồng độ thuốc trong huyết tương được sử dụng để đánh giá các thông số dược lực học quan trọng như vùng dưới đường cong (AUC_area under the curve), nồng độ đỉnh (Cmax), thời gian đạt được nồng độ đỉnh (Tmax), thời gian hấp thụ lưu (tlag). Thử nghiệm nên tiến hành trên nhiều mức nồng độ khác nhau, đặc biệt khi thuốc cho kết quả về dược lực học không theo đường tuyến tính. .
Ngoài các dữ liệu từ các nghiên cứu về tương đương sinh học, các dữ liệu khác có thể cũng cần để bổ sung cho hợp với yêu cầu về hồ sơ kiểm tra tương đương sinh học. Các bằng chứng có thể bào gồm:
·Giá trị của các phương pháp phân tích
·Các nghiên cứu tương quan đến in vitro-in vivo.
Một ví dụ về thử tương đương sinh học ở Malaysia: thiết kế nghiên cứu theo nghiên cứu mù và ngẫu nhiên. Đối tượng được chọn là 12-24 người trưởng thành, khỏe mạnh, không hút thuốc và được tầm soát rất kỹ về tính nghiện rượu. Với loại thuốc có khuynh hướng thay đổi nhiều thì được thử nghiệm với số người cao hơn. Tuổi của các đối tượng được khuyến cáo là nên trong khoảng 18-55 tuổi, có cân nặng trung bình. Họ phải tránh sử dụng tất cả các loại thuốc trong khoảng 2 tuần trước khi nghiên cứu. Việc nghiên cứu phải được sự chấp thuận của tất cả các đối tượng. Ngoài ra, chế độ ăn uống của các đối tượng cũng là một vấn đề phải được đặc biệt quan tâm. Các đối tượng phải nhịn đói qua đêm để thuốc nghiên cứu hấp thu tốt hơn và bữa ăn sáng vào ngày hôm sau phải ít chất béo.
Về chuyên môn, nhóm chuyên gia nghiên cứu gồm bác sĩ lâm sàng, liên tục giám sát y khoa vàkhông được bỏ qua bất kỳ tác dụng phụ nào, dù nhỏ nhất. Một nhà dược động lực học chuyên xác định thời gian lấy mẫu máu và một nhà hóa học phân tích lượng thuốc trong mẫu. Nghiên cứu phải được tiến hành tại bệnh viện để kịp thời xử lý các tình huống cấp cứu có thể xảy ra. Bên cạnh đó, phòng thí nghiệm lâm sàng phải được chuẩn bị sẵn sàng cho các phân tích trong phòng thí nghiệm để xác định tình trạng sức khỏe của các đối tượng. Các mẫu được phân tích bằng thiết bị chuẩn hóa. Sau hàng loạt các nghiên cứu đã thực hiện, báo cáo sẽ được trình lên Cục kiểm soát dược phẩm quốc gia để quyết định xem thuốc generic vừa qua thực nghiệm có được xem là tương đương sinh học hay không. Nếu đạt chuẩn, mới được đưa ra thị trường. Các chuyên gia cũng đặc biệt nhấn mạnh, trong báo cáo phải mô tả toàn bộ phác đồ nghiên cứu bao gồm tất cả tiến trình về lâm sàng, phân tích và thống kê, số liệu thô, công thức thuốc, nơi nghiên cứu và thông tin toàn diện về các đối tượng tham gia thử thuốc generic.
Hai thuốc muốn đạt được tính sinh khả dụng tương đương thì khi vào cơ thể để phát huy tác dụng trị bệnh, chúng phải có các pha tác động giống nhau, cụ thể là: +Pha sinh dược học: gồm giai đoạn phóng thích hoạt chất, giai đoạn hòa tan để hoạt chất có thể xuyên qua màng sinh học. +Pha dược động học: gồm giai đoạn hấp thu để hoạt chất đi vào máu, giai đoạn phân bố máu đưa hoạt chất đến các cơ quan, các mô tạo nên tác động và cuối cùng là giai đoạn thải trừ ra khỏi cơ thể. +Pha dược lực học: Hoạt chất khuếch tán đến nơi tác động rồi phối hợp với một thụ thể, men hay cấu trúc tế bào để tạo ra hiệu quả trị bệnh mong muốn.
Một số quy định tại các quốc gia về tương đương sinh học
Tại Úc: cơ quan liên quan đến quản lý các vấn đề điều trị (Therapeutics Goods Administration_TGA) có cân nhắc đến các chế phẩm dược được xem là tương đương sinh học nếu với khoảng tin cậy CI 90% sự chuyển dạng sinh học tự nhiên tương đương giữa 2 chế phẩm, nồng độ thuốc tối đa (Cmax) và nồng độ thuốc dưới đường cong (AUC) nằm trong khoảng 0.80-1.25. Thời gian đạt nồng độ đỉnh (Tmax) cũng nên tương đương giữa các sản phẩm.
Tại châu Âu: theo quy định chuẩn của cộng đồng châu Âu EMEA-CPMP, và hướng dẫn về điều tra tính tương đương sinh học cũng như sinh khả dụng của thuốc (London, tháng 7.2001). CPMP/EWP/QWP/1401/98 rằng 2 chế phẩm được xem là có tương đương sinh học nếu chúng tương đương về mặt dược lý học và nếu sinh khả dụng của chúng sau khi chỉ định cùng liều phân tử gam như nhau và hiệu dụng như nhau, cả về hiệu lực của thuốc và tính an toàn cũng cần thiết. khoảng tin cậy CI 90% sự chuyển dạng sinh học tự nhiên tương đương giữa 2 chế phẩm, nồng độ thuốc tối đa (Cmax) và vùng dưới đường cong (AUC) nằm trong khoảng 0.80-1.25.
Tại Mỹ: Cơ quan FDA xem 2 chế phẩm tương đương về mặt sinh học nếu khoảng tin cậy CI 90% liên với Cmax, AUC(0-t) và AUC(0-∞) của thử nghiệm (chẳng hạn công thức thuốc generic) để tham chiếu (như với thuốc có công thức sáng kiến trước đó hay brand-name). nên trong khoảng 80% – 125% khi tình trạng bệnh nhân đói. Mặc dù có một vài ngoại lệ, nhìn chung một so sánh tương đương sinh học với công thức chuẩn đòi hỏi chỉnh định thuốc sau một bữa ăn hợp lý vào một thời điểm đặc biệt trước khi uống thuốc, người ta gọi là hiệu ứng liên đới đến thức ăn (“food-effect”). Một nghiên cứu “food-effect” yêu cầu đánh giá các giá trị thống kê tương đương như nghiên cứu khi đói ở trên.
Điểm khác biệt giữa thuốc generic với thuốc sáng chế: nhiều nghiên cứu và điều tra, các bộ phận đăng ký ở các nước phát triển lớn như Mỹ, Úc hoặc châu Âu nhận thấy rằng tương đương sinh học là cách thích hợp nhất để chứng tỏ sự tương thích trị liệu giữa thuốc generic và thuốc sáng chế. Một thuốc generic có chất lượng là một thuốc chứng minh được tính tương đương sinh học so với thuốc sáng chế. Trong thực tế sản xuất, các tiêu chuẩn thực hành sản xuất thuốc tốt của trang thiết bị sản xuất cho thuốc generic và thuốc sáng chế là hoàn toàn giống nhau. Cơ quan quản lý dược phẩm của Bộ Y tế Malaysia đã coi việc chứng minh tương đương sinh học là một yêu cầu cho một số nhóm dược phẩm generic được sử dụng theo đường uống và phóng thích nhanh. Uỷ ban quốc gia về nghiên cứu tương đương sinh học ban hành thời hạn cuối cùng để nộp các dữ liệu tương đương sinh học cho mỗi loại thuốc. Các công ty dược cho thời hạn tối đa lên đến một năm để đưa ra các dữ liệu chứng minh tương đương sinh học. Nếu sau thời hạn này mà vẫn chưa trình được kết quả, sản phẩm sẽ tự động bị rút số đăng ký và sẽ không được lưu hành trên thị trường.
Thực tế các biệt dược tràn lan trên thị trường, như vậy làm sao để đánh giá đó là một thuốc tốt, chúng ta cần xem xét tới sinh khả dụng và tương đương sinh học. Với việc áp dụng dược động học, dược lực học, quan sát và thử nghiệm lâm sàng, kể cả các thử nghiệm in vitro: đo nồng độ huyết tương, đo lượng thuốc trong các dịch bài tiết (nước tiểu), đo phản ứng dược lực cấp, đánh giá lâm sàng, độ hòa tan, độ phóng thích thuốc (tính tan, tính thấm) để khẳng định thuốc nào là tốt
Như vậy trên đây chúng tôi đã giới thiệu đến bạn đọc Bioavailability là gì? Vai trò của tương đương sinh học và sinh khả dụng. Hy vọng bài viết này giúp ích cho bạn trong cuộc sống cũng như trong học tập thường ngày. Chúng tôi xin tạm dừng bài viết này tại đây.
Website: https://phebinhvanhoc.com.vn/
Thông báo: Phê Bình Văn Học ngoài phục vụ bạn đọc ở Việt Nam chúng tôi còn có kênh tiếng anh PhebinhvanhocEN cho bạn đọc trên toàn thế giới, mời thính giả đón xem.
Chúng tôi Xin cám ơn!

